技术专题
Cell:哇!单基因可逆转结肠癌 重建正常组织功能
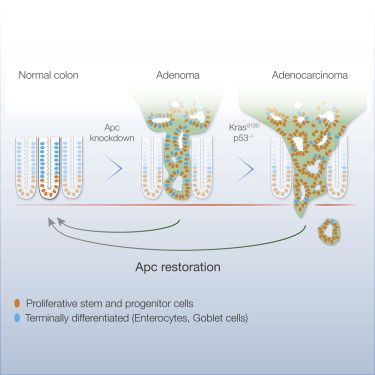
近日,来自美国的科学家在国际学术期刊cell发表了一项最新研究进展,与以往直接杀死肿瘤细胞的策略不同,他们发现在小鼠中将一个与人类结肠癌有关的基因恢复到正常水平可以抑制肿瘤生长并在4天内重建正常的小肠功能。更令人惊奇的是,肿瘤在两周内慢慢消除,癌症症状也在随后的几个月内得到了改善。结肠癌是发达国家中导致癌症相关死亡的第二号杀手,每年全世界大约有700,000人死于结肠癌。目前治疗晚期结肠癌的主要策略还是不同化疗药物的联合治疗,这种方法毒性大并且治疗效率并不高,但在过去十年中,结肠癌的治疗仍以此方法为主。
研究人员指出,高达90%的结肠癌包含一种叫作adenomatous polyposis coli(Apc)的肿瘤抑制基因的失活突变,有研究证明这些基因突变在结肠癌起始过程中有重要作用,但Apc失活是否在肿瘤发生之后的肿瘤生长和存活过程中也扮演重要角色仍未可知。
在该项研究中,研究人员利用一种基因操作技术在一种结肠癌小鼠模型中精确并可逆地重新激活了Apc活性。在目前大多数结肠癌小鼠模型中,肿瘤主要发生在小肠,而该研究所使用的小鼠模型肿瘤不仅发生在小肠还会发生在结肠,与人类结肠癌的发生更加类似。在对Apc活性进行重新激活之后,wnt信号恢复到正常水平,肿瘤细胞也停止了增殖,同时小肠细胞也恢复了正常功能,随后两周内,肿瘤受到抑制并逐渐消失,研究人员又进行了6个月跟踪观察也没有发现癌症有复发迹象。除此之外,研究人员指出这种方法对于治疗携带Kras和p53突变的恶性结肠癌也非常有效。
综上所述,这项研究发现在结肠癌小鼠模型中重新激活Apc基因表达可以抑制肿瘤生长,恢复小肠正常功能。这为利用重建单个肿瘤抑制性基因抑制肿瘤生长的方法提供了重要证据,表明这一方法可成为癌症治疗的新策略。
DOI: http://dx.doi.org/10.1016/j.cell.2015.05.033
Apc Restoration Promotes Cellular Differentiation and Reestablishes Crypt Homeostasis in Colorectal Cancer
Lukas E. Dow56, Kevin P. O'Rourke5, Janelle Simon, Darjus F. Tschaharganeh, Johan H. van Es, Hans Clevers, Scott W. Lowe
The adenomatous polyposis coli (APC) tumor suppressor is mutated in the vast majority of human colorectal cancers (CRC) and leads to deregulated Wnt signaling. To determine whether Apc disruption is required for tumor maintenance, we developed a mouse model of CRC whereby Apc can be conditionally suppressed using a doxycycline-regulated shRNA. Apc suppression produces adenomas in both the small intestine and colon that, in the presence of Kras and p53 mutations, can progress to invasive carcinoma. In established tumors, Apc restoration drives rapid and widespread tumor-cell differentiation and sustained regression without relapse. Tumor regression is accompanied by the re-establishment of normal crypt-villus homeostasis, such that once aberrantly proliferating cells reacquire self-renewal and multi-lineage differentiation capability. Our study reveals that CRC cells can revert to functioning normal cells given appropriate signals and provide compelling in vivo validation of the Wnt pathway as a therapeutic target for treatment of CRC.
